కాంపౌండ్ వర్సెస్ మిశ్రమం
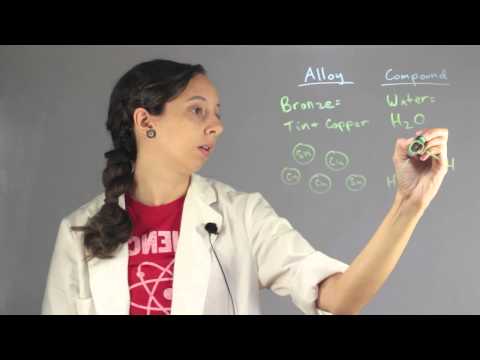
విషయము
- విషయ సూచిక: సమ్మేళనం మరియు మిశ్రమం మధ్య వ్యత్యాసం
- పోలిక చార్ట్
- సమ్మేళనం అంటే ఏమిటి?
- సమయోజనీయ బాండ్
- అయానిక్ బాండ్
- మెటాలిక్ బాండ్
- మిశ్రమం అంటే ఏమిటి?
- సజాతీయ మిశ్రమం
- భిన్నమైన మిశ్రమం
- సొల్యూషన్
- మిశ్రమంలో
- సస్పెన్షన్
- కీ తేడాలు
- ముగింపు
సమ్మేళనం మరియు మిశ్రమం మరియు సమ్మేళనం మధ్య వ్యత్యాసం ఏమిటంటే, మిశ్రమంలో, విభిన్న మూలకాలు భౌతికంగా రసాయన బంధాలను కలిగి ఉండవు, ఏ నిష్పత్తి సమ్మేళనాలలోనైనా, కణాలు ఒక నిర్దిష్ట నిష్పత్తిలో కొన్ని రసాయన బంధాల ద్వారా కలిసిపోతాయి.

విశ్వం పదార్థంతో కూడి ఉంటుంది, మరియు పదార్థం యొక్క మూడు ప్రధాన రూపాలు ఉన్నాయి. మూలకం, సమ్మేళనం మరియు మిశ్రమం. ఒక మూలకం అణువులతో మరియు ఒకే రకమైన అణువులతో తయారైన స్వచ్ఛమైన పదార్థం, మిశ్రమాలు మరియు సమ్మేళనాలు ఒకటి కంటే ఎక్కువ మూలకాలతో తయారవుతాయి. మిశ్రమాలలో, రకాలు కంటే రెండు లేదా అంతకంటే ఎక్కువ మూలకాలు ఏ పరిమాణంలోనైనా భౌతికంగా ఏకం అవుతాయి. వారికి నిర్దిష్ట నిష్పత్తి లేదు. సమ్మేళనాలలో ఉన్నప్పుడు, రెండు లేదా అంతకంటే ఎక్కువ రకాల మూలకాలు కొన్ని రసాయన బంధాల ద్వారా ఏకం అవుతాయి. మార్చలేని ఒక నిర్దిష్ట నిర్దిష్ట నిష్పత్తిలో అవి కలిసిపోతాయి.
మిశ్రమం యొక్క కూర్పు పరిష్కరించబడలేదు. ఇది మారవచ్చు. సమ్మేళనం పరిష్కరించబడింది. ఆ కూర్పు మార్చబడితే, సమ్మేళనం మరొక సమ్మేళనానికి మార్చబడుతుంది. అందువల్ల మిశ్రమం స్వచ్ఛమైన విషయం కాదు, సమ్మేళనం స్వచ్ఛమైన విషయం.
మిశ్రమాన్ని ఏర్పరుస్తున్న కణాలు వాటి అసలు లక్షణాలను కలిగి ఉంటాయి ఎందుకంటే అవి భౌతికంగా బంధించబడతాయి, అయితే సమ్మేళనం ఏర్పడే కణాలు వాటి అసలు లక్షణాలను కోల్పోతాయి ఎందుకంటే వాటి మధ్య రసాయన బంధాలు వాటి రసాయన స్వభావాన్ని మారుస్తాయి.
మిశ్రమాలకు నిర్వచించిన ద్రవీభవన మరియు మరిగే బిందువులు లేవు. సమ్మేళనాలు వాటి భాగాల ద్రవీభవన మరియు మరిగే బిందువుల నుండి స్వతంత్రంగా ఉడకబెట్టడం మరియు ద్రవీభవన స్థానాలను కలిగి ఉండగా, ఇది వాటిలో ఉన్న కణాల రకాలను బట్టి ఉంటుంది.
మిశ్రమాన్ని రూపొందించడానికి అంశాలు భౌతికంగా చేరినప్పుడు, క్రొత్త విషయం ఏర్పడదు. కానీ సమ్మేళనం ఏర్పడటానికి మూలకాలు రసాయనికంగా చేరినప్పుడు, క్రొత్త విషయం ఉనికిలోకి వస్తుంది.
సాధారణ భౌతిక పద్ధతుల ద్వారా మిశ్రమాలను సులభంగా వేరు చేయవచ్చు. సమ్మేళనాలు వేరు చేయలేవు మరియు వాటి భాగాలు వేరు చేయవలసి వస్తే, నిర్దిష్ట రసాయన పద్ధతులు అవలంబిస్తాయి.
మిశ్రమాలను 5 రకాలుగా విభజించారు, అనగా సజాతీయ మిశ్రమాలు, భిన్నమైన మిశ్రమాలు, ఘర్షణ, పరిష్కారం మరియు సస్పెన్షన్. సమ్మేళనాలు దాని భాగాల మధ్య బంధం ఉనికి ఆధారంగా సమూహాలుగా విభజించబడ్డాయి. ఇది అయానిక్ బంధం, సమయోజనీయ బంధం మరియు లోహ బంధం కావచ్చు.
మిశ్రమాల లక్షణాలు నిర్ణయించబడవు. అవి వాటి భాగాల పరిమాణం మరియు నిష్పత్తిపై ఆధారపడి ఉంటాయి. సమ్మేళనాల లక్షణాలు నిర్ణయించబడతాయి.
మిశ్రమాలకు రసాయన సూత్రం ఇవ్వలేము, అయితే సమ్మేళనాలు వాటి ప్రత్యేకమైన రసాయన సూత్రాలను కలిగి ఉంటాయి.
మిశ్రమం ఏర్పడేటప్పుడు, శక్తి అవసరం లేదు, మరియు సమ్మేళనాలు ఏర్పడేటప్పుడు, శక్తి విడుదల చేయబడదు, శక్తి విడుదల అవుతుంది లేదా గ్రహించబడుతుంది మరియు చుట్టుపక్కల ఉష్ణోగ్రత తగ్గుతుంది లేదా పెరుగుతుంది, ఇది ఎక్సోథర్మిక్ లేదా ఎండోథెర్మిక్ రసాయన ప్రతిచర్య.
మిశ్రమాలకు ఉదాహరణలు సాధారణ సెలైన్ ద్రావణం (సోడియం క్లోరైడ్ మరియు నీరు) మరియు నీరు లేదా లోహ మిశ్రమాలలో గ్లూకోజ్. సమ్మేళనాల ఉదాహరణలు కార్బన్ డయాక్సైడ్ (CO2), మీథేన్ గ్యాస్ (CH4) లేదా అమ్మోనియా గ్యాస్ (NH3) గా ఇవ్వవచ్చు.
విషయ సూచిక: సమ్మేళనం మరియు మిశ్రమం మధ్య వ్యత్యాసం
- పోలిక చార్ట్
- సమ్మేళనం అంటే ఏమిటి?
- సమయోజనీయ బాండ్
- అయానిక్ బాండ్
- మెటాలిక్ బాండ్
- మిశ్రమం అంటే ఏమిటి?
- సజాతీయ మిశ్రమం
- భిన్నమైన మిశ్రమం
- సొల్యూషన్
- మిశ్రమంలో
- సస్పెన్షన్
- కీ తేడాలు
- ముగింపు
పోలిక చార్ట్
| ఆధారంగా | మిశ్రమాలను | కాంపౌండ్స్ |
| మూలకాల యూనియన్. | మిశ్రమాలలో, మూలకాలు భౌతికంగా కలిసి ఉంటాయి. | సమ్మేళనాలలో, మూలకాలు కొన్ని రసాయన బంధాల ద్వారా కలిసి ఉంటాయి. |
| మూలకాల నిష్పత్తి | వాటిలో మూలకాల యొక్క నిర్దిష్ట నిష్పత్తి లేదు. | వాటిలో మూలకాల యొక్క నిర్దిష్ట నిష్పత్తి. |
| రసాయన సూత్రం | వారికి రసాయన సూత్రం ఇవ్వలేము. | వారికి నిర్దిష్ట రసాయన సూత్రాన్ని కేటాయించారు. |
| ద్రవీభవన మరియు మరిగే పాయింట్లు | వారు ద్రవీభవన మరియు మరిగే బిందువులను నిర్వచించలేదు. | వారు తమ భాగాల ద్రవీభవన మరియు మరిగే బిందువులతో సంబంధం లేకుండా ద్రవీభవన మరియు మరిగే బిందువులను నిర్వచించారు. |
| భాగాలు వేరు | వారు సులభంగా వేరు చేయగలుగుతారు. | వాటిని సులభంగా వేరు చేయలేము మరియు వాటి భాగాలను వేరు చేయడానికి రసాయన పద్ధతులు అవసరం. |
| స్వచ్ఛత | మిశ్రమం ఎప్పుడూ స్వచ్ఛంగా ఉండదు. | సమ్మేళనం స్వచ్ఛమైన అస్తిత్వం. |
| కూర్పు | వాటికి స్థిర కూర్పు లేదు. | వారు ఎల్లప్పుడూ స్థిరమైన కూర్పును కలిగి ఉంటారు. |
| ఉప రకాలు | వాటిని 5 ఉప రకాలుగా విభజించారు. | వాటిని 3 ఉప రకాలుగా విభజించారు. |
| వేడి మార్పు మరియు శక్తి అవసరం | వాటి నిర్మాణం సమయంలో శక్తి అవసరం లేదు, కాబట్టి వేడిలో ఎటువంటి మార్పు జరగదు. | అవి ఏర్పడేటప్పుడు శక్తిని విడుదల చేస్తాయి లేదా గ్రహిస్తాయి, కాబట్టి ఉష్ణోగ్రత పెరుగుతుంది లేదా పడిపోతుంది. |
| గుణాలు | వాటి లక్షణాలు నిర్ణయించబడవు. | వాటి లక్షణాలు ఎల్లప్పుడూ నిర్ణయించబడతాయి. |
| క్రొత్త విషయం | అంశాలు భౌతికంగా చేరినప్పుడు, క్రొత్త విషయం ఏర్పడదు. | అంశాలు రసాయనికంగా చేరినప్పుడు, ఎల్లప్పుడూ క్రొత్త విషయం ఏర్పడుతుంది. |
| ఉదాహరణలు | సాధారణ సెలైన్, సముద్రపు నీరు, గ్లూకోజ్లో నీరు, 2 పొడులు కలిపి. | కార్బన్ డయాక్సైడ్, అమ్మోనియా గ్యాస్, మీథేన్, ప్రొపేన్ మొదలైనవి. |
సమ్మేళనం అంటే ఏమిటి?
సమ్మేళనాలు అంటే వాటి నిష్పత్తి కణాలు నిర్దిష్ట నిష్పత్తిలో కొన్ని రసాయన బంధాల ద్వారా కలిసిపోయే పదార్థాలు, తద్వారా కొత్త అస్తిత్వం ఉనికిలోకి వస్తుంది. వారు నిర్వచించిన మరిగే మరియు ద్రవీభవన స్థానాలు మరియు ఇతర రసాయన లేదా భౌతిక లక్షణాలను కలిగి ఉంటారు.

వాటి మూలక మూలకాల మధ్య రసాయన బంధాల స్వభావాన్ని బట్టి అవి 3 ఉప రకాలుగా విభజించబడ్డాయి. ఈ బంధాలు కావచ్చు
సమయోజనీయ బాండ్
రెండు అణువుల మధ్య ఎలక్ట్రాన్ జత పంచుకునే రసాయన బంధం.
అయానిక్ బాండ్
ఒక రసాయన బంధం, దీనిలో వాలెన్స్ ఎలక్ట్రాన్లు ఒక అణువు నుండి మరొక అణువుకు వ్యాపిస్తాయి.
మెటాలిక్ బాండ్
రెండు లోహాల అయాన్ల మధ్య ఆకర్షణ యొక్క ఎలెక్ట్రోస్టాటిక్ శక్తి కారణంగా ఏర్పడే బంధం.
మిశ్రమం అంటే ఏమిటి?
మిశ్రమాలు రెండు లేదా అంతకంటే ఎక్కువ మూలకాలు భౌతికంగా కలిసిపోతాయి మరియు రసాయన బంధాల ద్వారా కాదు. ఈ మూలకాలను ఏ నిష్పత్తిలోనైనా కలపవచ్చు. అందువలన మిశ్రమం స్వచ్ఛమైన అస్తిత్వం కాదు. వాటికి కొన్ని నిర్దిష్ట ఉడకబెట్టడం లేదు, మరియు ద్రవీభవన స్థానాలు మరియు కణాలు ఏర్పడే సరళమైన పద్ధతులు లేదా వడపోత, అవక్షేపం, సెంట్రిఫ్యూగేషన్, మరిగే మొదలైన భౌతిక పద్ధతులను ఉపయోగించి సులభంగా వేరు చేయబడతాయి.

మిశ్రమాలను 5 ఉప రకాలుగా విభజించవచ్చు, అనగా సజాతీయ మిశ్రమాలు, భిన్నమైన మిశ్రమాలు, పరిష్కారం, సస్పెన్షన్ మరియు కొల్లాయిడ్.
సజాతీయ మిశ్రమం
సజాతీయ మిశ్రమాలు అంటే వాటిలోని కణాలు ద్రావణం అంతటా సమానంగా పంపిణీ చేయబడతాయి. మద్యం నీటిలో కలిపినప్పుడు లేదా నీటిలో చక్కెర ద్రావణం అయినప్పుడు వారి ఉదాహరణలు ఇవ్వవచ్చు.
భిన్నమైన మిశ్రమం
ఒక భిన్నమైన మిశ్రమం అంటే దానిలోని కణాలు ద్రావణంపై ఒకే విధంగా పంపిణీ చేయబడవు. నూనెను నీటిలో కలిపినప్పుడు లేదా ఇనుప పొడితో సల్ఫర్ మిశ్రమంగా ఉన్నప్పుడు వాటి ఉదాహరణలు ఇవ్వవచ్చు.
ఈ రకాలు కాకుండా, మిశ్రమాలను కూడా 3 రకాలుగా వర్గీకరించవచ్చు. ఇవి
సొల్యూషన్
నానో పరిమాణంలోని కణాలను కలిగి ఉన్న మిశ్రమాలు ఇవి. వాటి భాగాలు 1nm కన్నా తక్కువ. ఉదాహరణకు నీటిలో ఆక్సిజన్ మిశ్రమం.
మిశ్రమంలో
ఇవి కంటితో కనిపించేంత చిన్నవిగా ఉండే మిశ్రమాలు, అయితే వాటి కణాల పరిమాణం 1nm నుండి 1mm మధ్య ఉంటుంది. వారి ఉదాహరణలు రక్తం, పొగ మరియు క్రీమ్ గా ఇవ్వవచ్చు.
సస్పెన్షన్
అవి కణాలు పెద్దవిగా ఉండే మిశ్రమాలు, అవి సెంట్రిఫ్యూగేషన్ పద్ధతి ద్వారా వేరు చేయబడతాయి. వాటి ఉదాహరణలు గాలిలో మట్టి లేదా కాలుష్య కారకాలుగా ఇవ్వవచ్చు.
కీ తేడాలు
- వేర్వేరు మూలకాల యొక్క రెండు లేదా అంతకంటే ఎక్కువ కణాలు భౌతికంగా చేరడం వల్ల ఏర్పడిన మిశ్రమాలు, ఒక నిర్దిష్ట నిష్పత్తిలో రెండు లేదా అంతకంటే ఎక్కువ మూలకాల అణువుల మధ్య రసాయన బంధం కారణంగా సమ్మేళనాలు ఏర్పడతాయి.
- సమ్మేళనాలు ఉన్నప్పుడు మిశ్రమాలకు నిర్దిష్ట లక్షణాలు లేదా ద్రవీభవన మరియు మరిగే పాయింట్లు ఉండవు.
- మిశ్రమాల కణాలను భౌతిక పద్ధతుల ద్వారా సులభంగా వేరు చేయవచ్చు, అయితే సమ్మేళనాల రసాయన పద్ధతులు అవసరం.
- మిశ్రమాల ఏర్పడేటప్పుడు వేడి మార్పు జరగదు, అయితే సమ్మేళనాల రూపం 3 సమయంలో ఉష్ణ మార్పు జరుగుతుంది.
- మిశ్రమాలకు స్థిరమైన కూర్పు ఉండదు, సమ్మేళనాలు స్థిరమైన కూర్పును కలిగి ఉంటాయి.
ముగింపు
విశ్వం వివిధ మూలకాలతో తయారైన సమ్మేళనాలు మరియు మిశ్రమాలతో కూడి ఉంటుంది. అవి మన జీవితంలో ఒక భాగం. మిశ్రమాలు మరియు సమ్మేళనాలు రెండు లేదా అంతకంటే ఎక్కువ మూలకాలతో తయారవుతాయి కాబట్టి అవి తరచుగా కలిసిపోతాయి. పై వ్యాసంలో, సమ్మేళనం మరియు మిశ్రమం మధ్య స్పష్టమైన వ్యత్యాసాన్ని నేర్చుకున్నాము.